羅爾阿太菌生長曲線、原生質體制備條件及融合技術(二)
1.4原生質體制備及條件
1.4.1原生質體制備與再生取培養55 h的種子發酵液9 mL,取1 mL涂布于PDA培養基上,29℃條件下培養。其余8 mL菌懸液中加入1 mL 5.56 mmol·L——1的β-巰基乙醇,靜置30 min。6500 r·min——1離心15 min,棄上清液留菌絲體,滲透壓穩定劑洗滌2次。加入1 mL的酶液,32℃條件下60 r·min——1振蕩酶解,滲透壓穩定劑洗滌2次,去酶液,6500 r·min——1離心15 min,棄上清液留原生質體。原生質體保存于滲透壓穩定劑中,取1 mL涂布于低滲培養基,1 mL涂布于雙層再生培養基上,29℃條件下培養。按公式計算原生質體的形成率和再生率。
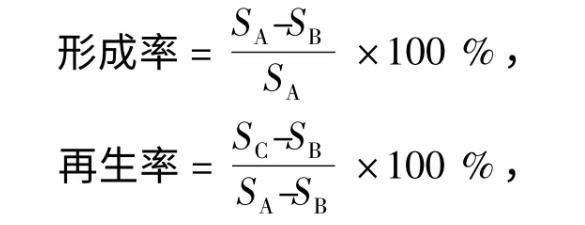
式中,SA、SB、SC分別為PDA培養基、低滲培養基、雙層再生培養基上的菌落面積(cm2)。
1.4.2原生質體制備條件的選擇
破壁酶:選用培養55 h的菌懸液,0.4 mol·L——1的KCl作為高滲穩定劑,3.1 mg·mL——1的酶,32℃酶解55 min,分別選擇7組酶進行單因素試驗。其中,第1組為纖維素酶(pH 5.0),第2組為蝸牛酶(pH 5.8),第3組為溶壁酶(pH 5.4),第4組為復合酶(纖維素酶φ為2%、蝸牛酶φ為4%、溶壁酶φ為2%,pH 5.5),第5組為復合酶(纖維素酶φ為2%、蝸牛酶φ為2%、溶壁酶φ為4%,pH 5.5),第6組為復合酶(纖維素酶φ為4%、蝸牛酶φ為2%、溶壁酶φ為2%,pH 5.5),第7組為復合酶(纖維素酶φ為2%、蝸牛酶φ為2%、溶壁酶φ為2%,pH 5.5)。
酶濃度:選用培養55 h的菌懸液,0.4 mol·L——1的KCl作為高滲穩定劑,分別選擇1.3、2.2、3.1、4.0、4.9和5.8 mg·mL——1的第5組復合酶,32℃條件下酶解55 min,進行單因素試驗。
酶解溫度:選用培養55 h的菌懸液,0.4 mol·L——1的KCl作為高滲穩定劑,3.1 mg·mL——1的第5組復合酶酶解55 min。分別選擇26、28、30、32、34和36℃進行單因素試驗。
酶解時間:選用培養55 h的菌懸液,0.4 mol·L——1的KCl作為高滲穩定劑,3.1 mg·mL——1的第5組復合酶32℃條件下分別振蕩酶解25、35、45、55、65、75和85 min進行單因素試驗。
pH:選用培養55 h的菌懸液,0.4 mol·L——1的KCl作為高滲穩定劑,3.1 mg·mL——1的復合酶(纖維素酶φ為2%、蝸牛酶φ為2%、溶壁酶φ為4%)32℃酶解55 min。pH分別選擇3.5、4.5、5.5、6.5、7.5、8.5進行單因素試驗。
滲透壓穩定劑:選用培養55 h的菌懸液,3.1 mg·mL——1的第5組復合酶,32℃酶解55 min。分別選擇0.4 mol·L——1的NaCl、蔗糖、KCl、MgSO4進行單因素試驗。
在上述單因素試驗基礎上,以原生質體形成率和再生率為指標,通過正交試驗L16(45)(表1)確定原生質體制備的最佳條件。
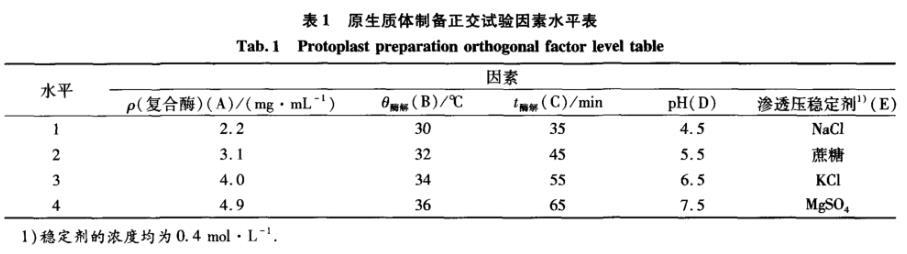
表1原生質體制備正交試驗因素水平表
1.5原生質體紫外滅活和熱滅活
將制備好的Ar-1和Ar-2原生質體懸浮液等體積混合,均分為2份,記為Ⅰ和Ⅱ,Ⅰ用于紫外滅活,Ⅱ用于熱滅活。
從Ⅰ中取1 mL涂布于雙層再生培養基上,29℃條件下培養。余下部分均分為6組,分別在紫外光下滅活1、3、5、7、9和11 min,各取1 mL涂布于再生雙層培養基上,29℃避光培養。
從Ⅱ中取1 mL涂布于雙層再生培養基上,29℃條件下培養。余下部分均分為21組,分別于45、55和65℃的恒溫水浴鍋中保溫15、25、35、45、55、65和75 min,各取1 mL涂布于再生雙層培養基上,29℃條件下培養。按公式計算原生質體滅活率。
滅活率=(Su-St)/Su*100%
式中,SU表示未經紫外和熱滅活的再生菌落面積(cm2),ST表示經紫外和熱滅活后的再生菌落面積(cm2)。
1.6原生質體融合
1.6.1原生質體融合分別取“1.5”中不同方法滅活的原生質體懸液,等體積混合均勻,6500 r·min——1離心15 min,棄上清液留原生質體。加入PEG6000促融,30℃水浴處理,不同時間段取出。0.4 mol·L——1的KCl洗滌2次,去除PEG6000,重懸于KCl中,取1 mL涂布于再生雙層培養基上,29℃培養,按公式計算原生質體的融合率。
融合率=Sr/Su*100%
式中,SR、SU分別表示融合子菌落面積和未滅活的原生質體再生菌落面積(cm2)。
1.6.2原生質體融合條件的選擇PEG6000濃度:向2 mL滅活后的原生質體懸液中分別加入4 mL 0.25、0.30、0.35、0.40、0.45和0.50 g·mL——1的PEG6000在30℃條件下融合25 min。
融合時間:向2 mL滅活后的原生質體懸液中分別加入4 mL 0.4 g·mL——1的PEG6000,在30℃條件下分別融合10、15、20、25、30和35 min。
融合溫度:向2 mL滅活后的原生質體懸液中分別加入4 mL 0.4 g·mL——1的PEG6000分別在26、28、30、32、34和36℃條件下融合25 min。
1.7融合子的篩選
再生培養基上長出融合子后,挑選長勢良好的融合子傳代5次,劃線法接種于PDA斜面培養基上,29℃條件下培養。轉接入種子培養基中,29℃、200 r·min——1空氣浴振蕩培養。再轉接入發酵培養基中,接種量為7%,29℃、200 r·min——1空氣浴振蕩培養5.5 d.測定發酵液中多糖及草酸產量,最終篩選出1株多糖產量高且草酸產量低的融合菌株。多糖含量的測定采用蒽酮硫酸法,草酸含量的測定采用分光光度法。
相關新聞推薦
2、不同的光照度、初始pH值、搖動次數等對光合細菌生長的影響
3、普城沙雷菌對黃瓜生長品質、根際土壤微生物數量的影響(一)
