使用雙膜溶解滲透裝置研究無定形固體分散體的體外-體內(nèi)關(guān)系
候選藥物的低水溶性是藥物開發(fā)中持續(xù)存在的挑戰(zhàn),估計(jì)70-90%的低分子量管道化合物被歸類為水溶性差。因此,多年來人們對(duì)幾種溶解度增強(qiáng)原理進(jìn)行了研究,例如重結(jié)晶成亞穩(wěn)態(tài)多晶型、非晶化、鹽形成、納米尺寸以及絡(luò)合劑和脂質(zhì)制劑的使用。由于缺乏適合所有水溶性差的藥物的金標(biāo)準(zhǔn)方法,對(duì)于特定的目標(biāo)藥物可能有不止一種合適的策略。因此,一些藥物以脂質(zhì)制劑和無定形固體分散體(ASD)的形式上市,如非諾貝特、利托那韋和依非韋倫。當(dāng)基質(zhì)溶解時(shí),藥物從制劑中釋放出來,因此可以進(jìn)入溶液,而不必克服其結(jié)晶對(duì)應(yīng)物的高晶格能。然而從藥物溶解到滲透的直接轉(zhuǎn)化有時(shí)會(huì)因此類過飽和系統(tǒng)的復(fù)雜性而變得復(fù)雜,因?yàn)檫^飽和溶液的表觀濃度是分子溶解藥物和膠體藥物的量度,例如溶解在膠束中、包含在環(huán)糊精或膠體中。影響通過在垂直D/P設(shè)置中加入額外的物理屏障來實(shí)現(xiàn)體外-體內(nèi)關(guān)系,允許在供體室和受體室中進(jìn)行攪拌,此前尚未有報(bào)道。因此,本論文研究的首要目的是調(diào)查基于PAMPA的D/P設(shè)置是否可能由于PAMPA膜和供體室之間不存在物理邊界而缺乏可預(yù)測性。目的是研究這種物理邊界的結(jié)合是否可以成功提高D/P設(shè)置的體內(nèi)可預(yù)測性。使用真空壓縮成型(VCM)制備抗逆轉(zhuǎn)錄病毒生物藥劑學(xué)分類系統(tǒng)II類藥物EFV的基于二元聚合物的ASD,用于評(píng)估。
丹麥Biosense微生物生長動(dòng)態(tài)監(jiān)測系統(tǒng)的應(yīng)用
使用oCelloScope?系統(tǒng)(BioSense Solutions,F(xiàn)arum,丹麥)對(duì)與兩種屏障類型接觸的藥物顆粒的潛在溶解進(jìn)行顯微鏡觀察。將疏水性PVDF過濾器(0.45μm)的圓形片(?=10 mm)放置在48孔板的孔底部,并通過添加GIT-脂質(zhì)將其制備為PAMPA膜。然后用一塊潤濕的親水性PVDF過濾器覆蓋其中一個(gè)膜,類似于D/P設(shè)置的條件,其中PAMPA膜和供體室之間包含物理邊界。在開始對(duì)屏障表面進(jìn)行30分鐘掃描之前,立即將磷酸鹽緩沖液(29 mM,pH 7.0)中的結(jié)晶EFV懸浮液添加到兩個(gè)孔中。使用UniExplorer軟件版本中的背景校正吸收(BCA)算法對(duì)收集的圖像進(jìn)行分析。
實(shí)驗(yàn)結(jié)論
使用無定形固體分散體(ASD)是一種常用的制劑策略,通過克服溶出速率和/或溶解度限制來提高難溶性藥物的口服生物利用度。雖然ASD的生物利用度增強(qiáng)已有充分記錄,但建立描述體外-體內(nèi)關(guān)系(IVIVR)的預(yù)測模型往往是一個(gè)挑戰(zhàn)。假設(shè)當(dāng)懸浮液中的藥物有可能與滲透屏障直接相互作用時(shí),體外溶解滲透(D/P)設(shè)置可能會(huì)高估藥物吸收。與基于平行的D/P設(shè)置中的四個(gè)ASD相比,純結(jié)晶依非韋倫的藥物吸收的過度預(yù)測支持了這一點(diǎn)人工膜通透性測定(PAMPA)。然而線性IVIVR(R 2=0.97)是在改進(jìn)的D/P設(shè)置中建立的,其中添加親水性PVDF過濾器充當(dāng)供體室和PAMPA膜之間的物理邊界。
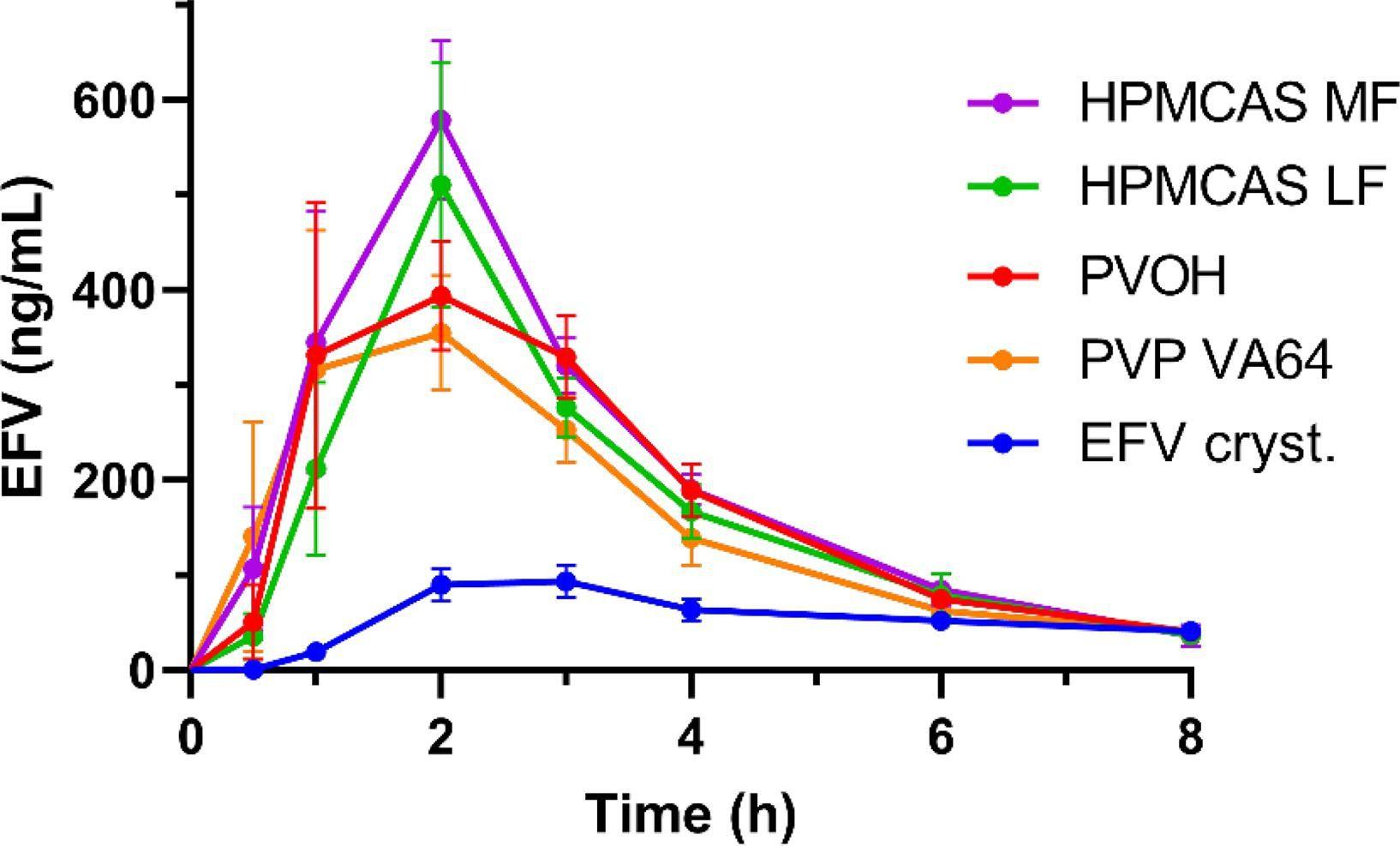
圖1、口服純結(jié)晶EFV和列出的聚合物基質(zhì)中20%(w/w)EFV的四種ASD后EFV的藥代動(dòng)力學(xué)特征。

圖2、兩種測試配方經(jīng)過粒度分級(jí)(180–355μm)后的掃描電子顯微照片。AC:在50°C下儲(chǔ)存四天后的純重結(jié)晶EFV顆粒。HPMCAS AS-LF中DF ASD為20%(w/w)EFV。
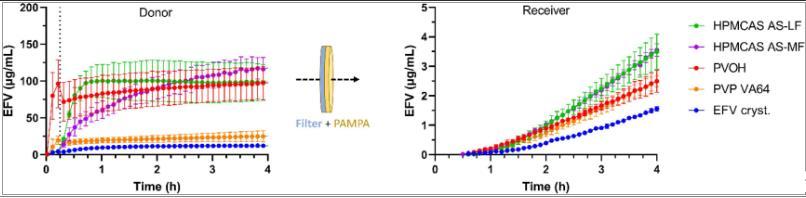
圖3、體外D/P設(shè)置的供體和受體室中的EFV濃度分布,包括。親水性PVDF過濾器作為PAMPA膜和供體室之間的物理邊界。將測試制劑(純結(jié)晶EFV和4個(gè)20%(w/w)EFV的ASD,在9號(hào)明膠膠囊中列出的聚合物基質(zhì)中)在t=0分鐘時(shí)添加到供體隔室中。左圖的虛線表示從胃部pH值3.5到腸道pH值7.0的變化。
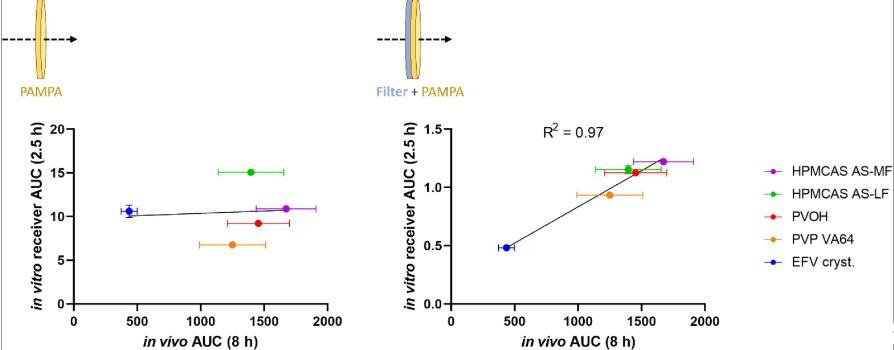
圖4、兩種體外D/P設(shè)置的最初2.5小時(shí)EFV接收者濃度的曲線下面積(AUC)作為大鼠EFV藥代動(dòng)力學(xué)曲線的完整8小時(shí)AUC的函數(shù)。五種測試制劑是純結(jié)晶EFV和四種在所列聚合物基質(zhì)中含有20%(w/w)EFV的ASD。左:僅使用PAMPA膜作為屏障的D/P設(shè)置的體外數(shù)據(jù)。右圖:來自D/P設(shè)置的體外數(shù)據(jù),其中附加的親水性PVDF過濾器作為PAMPA膜和供體室之間的物理邊界。
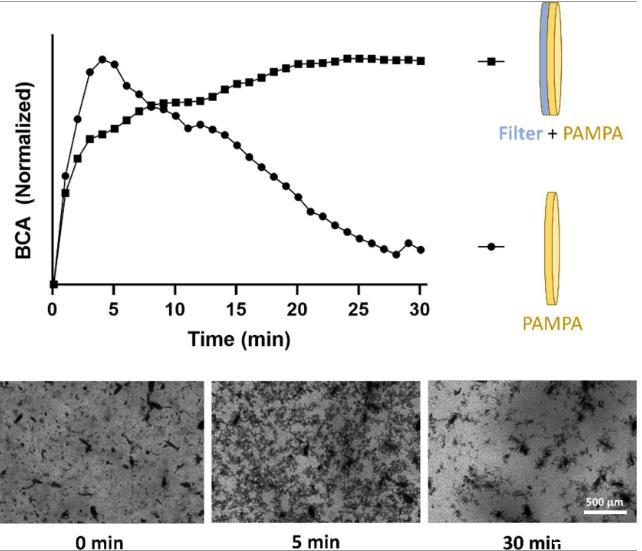
圖5、將兩種屏障類型浸入EFV的結(jié)晶懸浮液中,并使用oCelloScope?系統(tǒng)(BioSense Solutions,丹麥)監(jiān)測屏障表面。被EFV顆粒覆蓋的相對(duì)阻擋表面積如圖所示,以添加EFV結(jié)晶懸浮液后隨時(shí)間變化的歸一化BCA繪制。兩種屏障類型上EFV顆粒分布的圖像分析。上圖:標(biāo)準(zhǔn)化背景校正吸收(BCA)分析。底部0、5和30分鐘后EFV顆粒在PAMPA膜表面分布的圖像。
總結(jié)
本研究成功地在體外D/P設(shè)置和EFV的五種測試制劑(包括藥物)的大鼠PK研究之間建立了線性IVIVR(R 2=0.97)。四種ASD(以HPMCAS AS-LF和-MF、PVOH、PVPVA64作為載體聚合物)和結(jié)晶配方。這是通過修改D/P設(shè)置來實(shí)現(xiàn)的,在供體室和PAMPA膜之間添加物理邊界,從而防止懸浮液中的固體藥物顆粒與PAMPA膜的脂質(zhì)成分相互作用。基于Biosense微生物動(dòng)態(tài)監(jiān)測系統(tǒng)的顯微可視化,改進(jìn)的D/P設(shè)置的可預(yù)測性提高是由于避免了藥物顆粒直接溶解在PAMPA膜的脂質(zhì)成分中。這一原則可能有助于在啟動(dòng)動(dòng)物模型之前對(duì)水溶性差的藥物制劑進(jìn)行更可靠的評(píng)估。因此在評(píng)估容易引起沉淀的制劑時(shí),這種對(duì)通量的潛在貢獻(xiàn)通常可能是需要排除的相關(guān)因素。因此通過引入親水性過濾器相對(duì)容易地修改屏障,可能通過導(dǎo)致更準(zhǔn)確的排序和生物利用度改善的估計(jì),為啟用制劑的制劑開發(fā)提供更強(qiáng)的臨床前基礎(chǔ)。
相關(guān)新聞推薦
3、貝萊斯芽孢桿菌B.velezensis B6生長曲線、驅(qū)油功能特性評(píng)價(jià)(一)
